
El hidrocarburo que le sigue en simplicidad es aquel que está constituido por dos átomos de carbono. Su fórmula condensada es C2H6 y se le conoce como etano.
Si se continúan colocando átomos de carbono con enlaces sencillos entre ellos e hidrógenos en los enlaces libres, se crean largas cadenas de compuestos. Al etano le sigue el propano (C2H8) y a éste, el butano (C4H10). Todos estos compuestos forman parte de la familia de los alcanos, y sus nombres terminan con el sufijo –ano para indicar que pertenecen a la misma familia.
| Nombre | Fórmula semidesarrollada |
|---|---|
| Metano |
CH4 |
| Etano |
CH3– CH3 |
| Propano |
CH3– CH2– CH3 |
| Butano |
CH3– (CH2)2– CH3 |
| Pentano |
CH3– (CH2)3– CH3 |
| Hexano |
CH3– (CH2)4– CH3 |
| Heptano |
CH3– (CH2)5– CH3 |
| Octano |
CH3– (CH2)6– CH3 |
| Nonano |
CH3– (CH2)7– CH3 |
| Decano |
CH3– (CH2)8– CH3 |
| Nombre | Fórmula condensada |
|---|---|
| Eteno | C2H4 |
| Propeno | C3H6 |
| Buteno | C4H8 |
| Penteno | C5H10 |
| Hexeno | C6H12 |
| Hepteno | C7H14 |
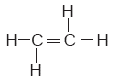
Los compuestos que presentan enlaces triples entre los átomos de carbono se llaman alquinos; sus nombres siempre terminan en –ino. Por ejemplo, éste es el etino (C2H2), también conocido como acetileno: H—C C—H.
| Nombre | Fórmula condensada |
|---|---|
| Etino | C2H2 |
| Propino | C3H4 |
| Butino | C4H6 |
| Pentino | C5H8 |
| Heptino | C |
| Hexino | C7H12 |
O bien:
Cuando los hidrocarburos están formados por varias ramificaciones, se denominan hidrocarburos arborescentes o ramificados. Algunas propiedades de los hidrocarburos ramificados difieren de las que presentan los hidrocarburos lineales. Los hidrocarburos lineales se utilizan mucho como disolventes industriales con el propósito de extraer aceites de semillas como la soya, el algodón y el maíz. Los hidrocarburos ramificados son componentes importantes de las gasolinas.
Los hidrocarburos lineales se encienden con relativa facilidad al comprimirlos. Eso provoca que se quemen prematuramente si son utilizados en el motor de un automóvil; son los causantes del “cascabeleo”. Los hidrocarburos ramificados no presentan esos problemas.
Los hidrocarburos también pueden formar ciclos cuando el último carbono de una cadena abierta se une con el primero. Los hidrocarburos cíclicos pueden formarse con tres o más átomos de carbono. Por ejemplo, el octano se enlaza para formar un ciclo (Fig. 1). Cuando el octano forma un ciclo, su nombre cambia a ciclooctano.
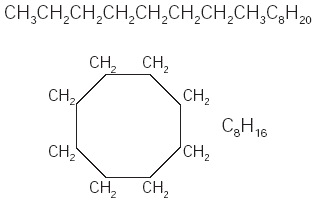
Fig. 1 Octano y ciclooctano.
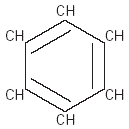
Fig. 2 Benceno.
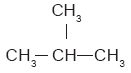
Aunque este compuesto posee la misma fórmula condensada que el butano: C4H10, se trata de compuestos diferentes; uno es un hidrocarburo lineal que se condensa a 0.5 °C y se conoce como butano normal, y el otro es un hidrocarburo ramificado, que se condensa a –12 °C y se llama isobutano.
A compuestos como éstos, que poseen la misma fórmula condensada pero diferente fórmula desarrollada, se les llama isómeros. Los isómeros son compuestos distintos uno de otro, con propiedades químicas y físicas también diferentes. El 1-penteno y el 2-penteno son isómeros. En este caso, se distinguen por la posición del doble enlace:
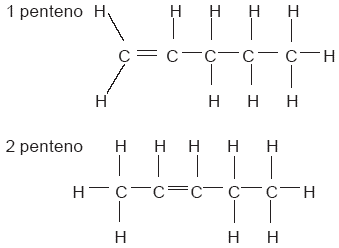
La mayoría de los hidrocarburos tienen isómeros, que se presentan en los siguientes casos:
- Cuando el doble o el triple enlace está en diferente posición.
- Cuando las ramificaciones aparecen en átomos de carbono diferentes.
En los alcanos, por ejemplo, hay tres posibles pentanos, cinco hexanos, nueve heptanos... y hasta 75 decanos diferentes.
Las moléculas de hidrocarburos pueden enlazarse con átomos distintos del carbono y el hidrógeno por medio de reacciones químicas; esto hace que presenten propiedades diferentes. Por ejemplo, la oxidación de los hidrocarburos para sustituir un hidrógeno por un grupo OH (grupo hidroxilo) da lugar a los alcoholes. Para nombrar a los alcoholes se emplea el nombre del hidrocarburo, seguido de la terminación –ol.
Algunos alcoholes tienen nombres comerciales. El más simple es el alcohol metílico o metanol (CH3—OH), pues tiene la cadena hidrocarbonada más corta. El metanol se utiliza en la fabricación del combustible para los aviones y en los anticongelantes para automóviles. No se debe confundir con el alcohol etílico o etanol (CH3—CH2—OH), que se encuentra en las bebidas alcohólicas. El metanol es muy venenoso y produce ceguera.
El metanol y el etanol son alcoholes primarios porque el grupo OH está unido a un átomo de carbono del extremo de la cadena.
El alcohol que sigue en tamaño al etanol es el propanol (CH3—CH2—CH2—OH), el cual tiene un isómero: el isopropanol o alcohol iso-propílico.
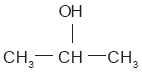
Este último compuesto se utiliza como desinfectante y con fines medicinales. A diferencia de los otros, se trata de un alcohol secundario porque el grupo OH se une a un átomo de carbono situado entre dos átomos del mismo elemento.
En los alcoholes terciarios, el grupo OH se enlaza a un átomo de carbono cuyos tres enlaces restantes se unen con átomos de carbono. Ejemplo de alcohol terciario es el ter-butanol:
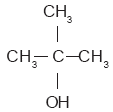
Los alcoholes primarios pueden reaccionar con algunas sustancias que actúan como agentes oxidantes. Estas sustancias convierten el enlace sencillo que une los átomos de carbono y oxígeno en un enlace doble. Para ello deben quitar al carbono un átomo de hidrógeno y otro al oxígeno, ya que este último elemento tiene una valencia igual que dos.
De esta forma se obtiene un aldehído. La terminación que se utiliza en los nombres de los aldehídos es –al. Por ejemplo, el etanol se oxida para producir etanal, cuyo nombre comercial es acetaldehído. La reacción se escribe como sigue:

donde la R representa cualquier hidrocarburo.
¿Los alcoholes secundarios reaccionan también con los reactivos oxidantes? Sí, pero no se produce un aldehído, sino una cetona. La terminación utilizada en los nombres de las cetonas es –ona. Para formar estos compuestos es necesaria también la eliminación de dos átomos de hidrógeno, como se observa a continuación:

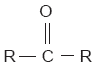
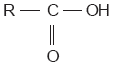

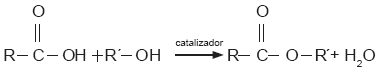
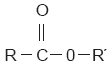
Los carbohidratos, glúcidos o azúcares son compuestos formados por carbono (C), hidrógeno (H) y oxígeno (O). Uno de los carbohidratos más comunes es la glucosa, cuya fórmula es C6H12O6. La glucosa tiene un isómero llamado fructuosa (C6H12O6); cuando estos dos compuestos se unen, forman la sacarosa o azúcar común (C12H22O11).
Las moléculas de carbohidratos se unen fácilmente unas con otras para formar largas cadenas o polímeros. Los polímeros formados de esta manera reciben el nombre de polisacáridos. La celulosa que forma el tronco de los árboles y el almidón, presente en granos y tubérculos, son ejemplos de polisacáridos.
Como la mayoría de los carbohidratos o glúcidos están constituidos por unidades con una estructura química similar, la combustión de todas estas sustancias produce la misma cantidad de energía, cerca de 4000 calorías (4 kilocalorías o 4 kcal) por cada gramo de compuesto que se quema. Una caloría es la cantidad de calor que se requiere para elevar 1°C 1 gramo de agua.
Las grasas son compuestos químicos que también están formados por carbono (C), hidrógeno (H) y oxígeno (O), pero contienen menos oxígeno que los carbohidratos; forman parte de los lípidos, un grupo de compuestos presentes en los tejidos de los seres vivos.
Las grasas se encuentran en los aceites naturales, la crema, la mantequilla y otros productos de origen animal. El cuerpo humano almacena la energía sobrante en forma de grasas, las cuales se acumulan alrededor de algunos órganos y debajo de la piel.
Las grasas son excelentes combustibles, pues liberan cerca de 9 kcal de energía por cada gramo que se quema; por esa razón, son utilizadas por el cuerpo para almacenar energía.
La tercera fuente de energía presente en los alimentos son las proteínas. Estos compuestos forman la estructura de todos los tejidos. La piel, el pelo, los huesos y los músculos de un ser humano están formados por proteínas. Las enzimas (o catalizadores naturales presentes en los organismos) encargadas de regular el metabolismo de los seres vivos también son proteínas.
Las proteínas son polímeros naturales, formados por la unión de monómeros conocidos como aminoácidos. El carbono (C), el hidrógeno (H), el oxígeno (O) y el nitrógeno (N) son sus elementos principales. Existen 20 tipos de aminoácidos, y en una proteína se unen cientos de ellos.
La mayor parte de las proteínas ingeridas en los alimentos son utilizadas por el cuerpo para construir los tejidos y las enzimas que requiere. Sólo en situaciones extremas, el cuerpo las oxida para obtener energía (por ejemplo, en casos de desnutrición extrema); cuando lo hace, se obtienen cerca de 4 kcal de energía por cada gramo de proteína quemada.
Los tres componentes principales de los alimentos cumplen una función esencial en el metabolismo corporal:
-
Carbohidratos. Proporcionar energía.
- Grasas. Almacenar energía.
- Proteínas. Formación de tejidos.
En general, se recomienda que el 60% de la energía obtenida de los alimentos provenga de los carbohidratos. Para consumir una dieta balanceada o equilibrada, no debe ingerirse en exceso ninguno de estos componentes; pero, sobre todo, hay que tener cuidado con el consumo de grasas pues son difíciles de eliminar.
Alcanos, Hidrocarburos cíclicos, Aldehídos y cetonas.
Alquenos y alquinos, Hidrocarburos aromáticos, Ácidos carboxílicos.
Hidrocarburos ramificados, Alcoholes, Ésteres.
Carbohidratos, Grasas, Proteínas.