La sal y el azúcar son dos sólidos blancos que pueden distinguirse a simple vista mediante una observación cuidadosa. Sin embargo, cuando están disueltos en agua, la vista no basta para distinguir una mezcla de otra, y aunque pueden probarse, eso no es recomendable cuando se trabaja con disoluciones desconocidas. La disolución de sal posee una característica particular, que ayuda a diferenciarla, por ejemplo, de la disolución de azúcar: conduce la electricidad.
La sal común (NaCl) pertenece a un grupo de compuestos químicos que favorecen el paso de la corriente eléctrica cuando se disuelven en agua. Esto quiere decir que permiten el movimiento o transporte de partículas con carga eléctrica de una región a otra dentro de la disolución. A este tipo de disoluciones se les denomina electrólitos para resaltar que poseen propiedades eléctricas. Otras sales, como el fluoruro de potasio (KF) o el cloruro de calcio (CaCl2), también son electrólitos.
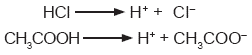
A los electrólitos fuertes que tienen propiedades ácidas o básicas se les llama también ácidos o bases fuertes, respectivamente. Por supuesto, también existen ácidos o bases débiles si se trata de electrólitos que no se disocian por completo en disolución acuosa.
Otros ejemplos de ácidos fuertes son el ácido sulfúrico (H2SO4), el ácido nítrico (HNO3) y el ácido bromhídrico (HBr). Un ácido débil es el ácido cítrico que se encuentra en frutas, como la naranja o el limón.
En el terreno de las sustancias básicas, los hidróxidos de sodio (NaOH) y el potasio (KOH) son bases fuertes, mientras el hidróxido de amonio (NH4OH) es una base débil.
La acidez o basicidad de una disolución depende de la cantidad de cationes H+ y aniones OH- que tenga; es decir, depende de la concentración de iones. Por eso una disolución 1 M de un ácido fuerte, como el ácido clorhídrico (HCI), será más ácida que una disolución de la misma concentración molar, pero de un ácido débil, como el acético (CH3COOH).
Para distinguir las disoluciones ácidas de las disoluciones básicas, se sigue una regla general fundamental en la concentración molar de los iones en disolución. Si la concentración de iones H+ es mayor que la de iones 0H- la disolución es ácida. Si por el contrario la concentración de iones 0H- es mayor, la disolución es básica o alcalina.
[H+ ] > [OH– ] disolución ácida
[H+ ] < [OH– ] disolución básica
En el caso particular de que la concentración de iones H+ sea igual que la de iones OH- ([H+]=[OH-]), se tiene una disolución neutra.
Para medir el grado de acidez o basicidad de las disoluciones, se emplea una escala de medida llamada escala de pH. En ella se asigna un valor entre 0 y 14 para indicar la acidez de la disolución. En las disoluciones ácidas cuya concentración de H+ es alta, el valor de pH es bajo; en las disoluciones básicas que presentan concentración de H+ menor, el valor de pH es alto.
En general, la acidez o basicidad de las disoluciones se establece por medio de la siguiente convención:
pH > 7 disolución básica
pH < 7 disolución ácida
pH = 7 disolución neutra
Aunque los seres vivos toleran ciertos niveles de acidez y basicidad, los ácidos y las bases pueden provocar serios problemas.
Veamos el ejemplo de la clara de huevo. Si se le agrega jugo de limón, que es ácido, la clara se pone blanca, como cuando se cuece. Lo que ocurre es que las proteínas que forman la clara de huevo se descomponen con los ácidos y por eso cambian de apariencia.
Los ácidos, al igual que las altas temperaturas, afectan a las proteínas. La mayoría de los seres vivos son sensibles a la acidez porque están hechos con proteínas. El cuerpo humano contiene sustancias que le permiten controlar el pH, pero a veces se ingieren tantas sustancias ácidas que el organismo no se da abasto. Y entonces, ¿cómo se puede contrarrestar la acción de los ácidos cuando no se quiere que actúen?
Para contrarrestar la acción de los ácidos se utilizan sus opuestos químicos: las bases. Cuando un ácido y una base se juntan y cancelan los efectos de ambos, se dice que han reaccionado para neutralizarse.