Los sentidos no permiten conocer la materia, a medida que pasamos de lo macroscópico (sustancias) a lo microscópico (átomos y moléculas), pero los científicos cuentan con medios para comprender mejor la estructura de esos átomos y moléculas que la constituyen. Entre éstos se encuentran la exposición de los elementos a diferentes manifestaciones de energía, como la eléctrica. Cuando se interpretan los resultados de los experimentos, se proponen modelos o representaciones de las partículas elementales del átomo.
A final del siglo XIX, el físico inglés Joseph John Thomson (1856-1940) descubrió que los átomos no eran simples esferas sólidas, como las había descrito Dalton. Mediante sus experimentos, relacionados con la interacción de la materia con la electricidad, Thomson descubrió la existencia de partículas atómicas con carga eléctrica negativa en el átomo, a las cuales denominó electrones, se proponen modelos o representaciones de las partículas elementales del átomo.

Fig. 1 Joseph John Thomson.

Fig. 2 Primer modelo electrónico de la materia.
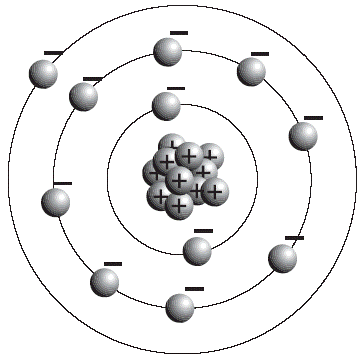
Fig. 3 Modelo planetario del átomo de sodio (Na). Los electrones describen órbitas alrededor del núcleo, donde se encuentran los protones.
Este científico inglés sabía que el átomo era eléctricamente neutro; es decir, no posee carga positiva ni negativa, por lo que desarrolló un modelo según el cual los electrones estaban insertos en una esfera con carga positiva (Fig. 2). De este modo, la carga de los átomos era 0.
Dicho modelo fue mejorado pronto por un alumno de Thomson: el neozelandés Ernest Rutherford (1871-1931), quien demostró, en 1911, que los átomos tenían también partículas positivas, a las que denominó protones. Estas partículas poseen una gran masa, comparada con la de los electrones. En el modelo propuesto de Rutherford, los protones están concentrados en una pequeña área, situada en el centro del átomo, que el investigador denominó núcleo Fig. 3).
De acuerdo con este modelo, el átomo consiste básicamente en un espacio vacío. El núcleo es muy pequeño en relación con el tamaño total del átomo, pero contiene prácticamente toda la masa de éste, pues la masa de los electrones es despreciable para fines prácticos.
Dos años más tarde, el danés Niels Bohr (1885-1962) modificó el modelo de Rutherford cuando propuso que cada electrón de un átomo dispone de una cantidad fija de energía, que lo mantiene en movimiento alrededor del núcleo, dentro de una región llamada órbita o nivel energético. En el modelo de Bohr, los niveles de energía que rodean el núcleo pueden compararse con las capas de una cebolla.
Cada nivel de energía puede interpretarse como el peldaño de una escalera con cierto número de electrones. Un electrón puede pasar de un peldaño a otro, pero no quedarse a la mitad, como una persona no puede subir la escalera si no se apoya en cada peldaño. Los modelos de Rutherford y Bohr combinados dan lugar a un modelo planetario del átomo: el núcleo equivaldría al Sol y los electrones a los planetas, que describen órbitas a diferentes distancias del núcleo.

Fig. 4 Niels Bohr.
Cuando los electrones que se mueven en determinadas órbitas son excitados (con el calor de la flama, por ejemplo), podemos lograr que pasen a la siguiente órbita, ya que han recibido energía que se los permite. Al regresar a su nivel normal de energía, y por lo tanto, a su órbita, la energía que absorbieron del calor la liberan en forma de luz de diferentes colores.
¿Cómo relaciona esto con la experiencia que realizó con el metal?