| Química orgánica | ||||||||||||||||||||||
| Alcanos | ||||||||||||||||||||||
El principal componente del gas natural es también el hidrocarburo más simple: el metano. Este compuesto está formado por un átomo de carbono y cuatro átomos de hidrógeno y se representa de dos formas: |
||||||||||||||||||||||
 |
||||||||||||||||||||||
El hidrocarburo que le sigue en simplicidad es aquel que está constituido por dos átomos de carbono. Su fórmula condensada es C2H6 y se le conoce como etano. Si se continúan colocando átomos de carbono con enlaces sencillos entre ellos e hidrógenos en los enlaces libres, se crean largas cadenas de compuestos. Al etano le sigue el propano (C2H8) y a éste, el butano (C4H10). Todos estos compuestos forman parte de la familia de los alcanos, y sus nombres terminan con el sufijo –ano para indicar que pertenecen a la misma familia. |
||||||||||||||||||||||
|
||||||||||||||||||||||
| Alquenos y alquinos | ||||||||||||||||||||||
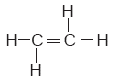
Si un hidrocarburo contiene enlaces dobles entre los átomos de carbono, no pertenece a la familia de los alcanos, sino a los alquenos. Considérese el siguiente ejemplo, donde se unen los dos átomos de carbono del etano (CH3—CH3) con un enlace doble. |
||||||||||||||||||||||
 |
||||||||||||||||||||||
En este caso se quitó un átomo de hidrógeno a cada átomo de carbono para que mantenga sus cuatro enlaces; a este compuesto se le conoce como eteno o etileno (C2H4). De manera análoga, si dos de los tres átomos de carbono del propano (C3H8) están unidos por un enlace doble en lugar de uno sencillo, el compuesto se llama propeno; su fórmula semidesarrollada es CH3—CH = CH2. Todos los alquenos tienen, al menos, un doble enlace entre átomos de carbono; el nombre de estos compuestos termina con el sufijo –eno como se ve en la tabla siguiente. |
||||||||||||||||||||||
|
||||||||||||||||||||||
Los compuestos que presentan enlaces triples entre los átomos de carbono se llaman alquinos; sus nombres siempre terminan en –ino. Por ejemplo, éste es el etino (C2H2), también conocido como acetileno: H—C C—H. |
||||||||||||||||||||||
|
||||||||||||||||||||||
Los alcanos son compuestos saturados porque no es posible adicionarles más átomos de hidrógeno. En cambio, en los alquenos y alquinos los enlaces dobles y triples pueden eliminarse por medios químicos para que cada átomo de carbono acepte más hidrógenos; por eso se dice que estos compuestos son insaturados. |
||||||||||||||||||||||
| Otros hidrocarburos | ||||||||||||||||||||||
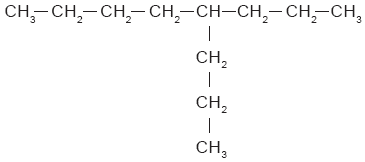
En muchos hidrocarburos, los átomos de carbono no sólo se unen para formar una cadena lineal, sino que presentan ramificaciones; esto es, cadenas de átomos de carbono que se unen a la principal eliminando un hidrógeno en ella. En seguida se muestran dos ejemplos: |
||||||||||||||||||||||
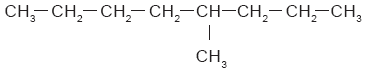 |
||||||||||||||||||||||
O bien: |
||||||||||||||||||||||
 |
||||||||||||||||||||||
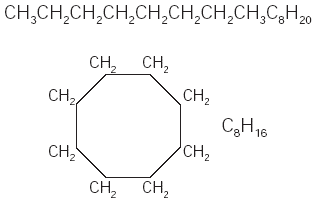
Cuando los hidrocarburos están formados por varias ramificaciones, se denominan hidrocarburos arborescentes o ramificados. Algunas propiedades de los hidrocarburos ramificados difieren de las que presentan los hidrocarburos lineales. Los hidrocarburos lineales se utilizan mucho como disolventes industriales con el propósito de extraer aceites de semillas como la soya, el algodón y el maíz. Los hidrocarburos ramificados son componentes importantes de las gasolinas. Los hidrocarburos lineales se encienden con relativa facilidad al comprimirlos. Eso provoca que se quemen prematuramente si son utilizados en el motor de un automóvil; son los causantes del “cascabeleo”. Los hidrocarburos ramificados no presentan esos problemas. Los hidrocarburos también pueden formar ciclos cuando el último carbono de una cadena abierta se une con el primero. Los hidrocarburos cíclicos pueden formarse con tres o más átomos de carbono. Por ejemplo, el octano se enlaza para formar un ciclo (Fig. 1). Cuando el octano forma un ciclo, su nombre cambia a ciclooctano. |
||||||||||||||||||||||
 |
||||||||||||||||||||||
Fig. 1 Octano y ciclooctano. |
||||||||||||||||||||||
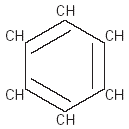
Un ejemplo importante de los hidrocarburos cíclicos es el benceno, cuya fórmula condensada o molecular es C6H6. Este compuesto es un disolvente industrial usado para la producción de insecticidas, explosivos y medicamentos. |
||||||||||||||||||||||
 |
||||||||||||||||||||||
Fig. 2 Benceno. |
||||||||||||||||||||||
| Los isómeros | ||||||||||||||||||||||
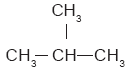
Algunos hidrocarburos presentan la misma fórmula condensada, pero diferente fórmula desarrollada; por ejemplo, el alcano ramificado: |
||||||||||||||||||||||
 |
||||||||||||||||||||||
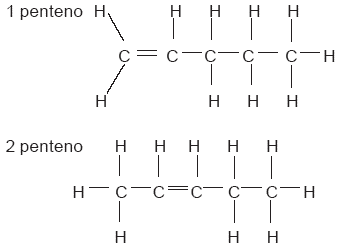
Aunque este compuesto posee la misma fórmula condensada que el butano: C4H10, se trata de compuestos diferentes; uno es un hidrocarburo lineal que se condensa a 0.5 °C y se conoce como butano normal, y el otro es un hidrocarburo ramificado, que se condensa a –12 °C y se llama isobutano. A compuestos como éstos, que poseen la misma fórmula condensada pero diferente fórmula desarrollada, se les llama isómeros. Los isómeros son compuestos distintos uno de otro, con propiedades químicas y físicas también diferentes. El 1-penteno y el 2-penteno son isómeros. En este caso, se distinguen por la posición del doble enlace: |
||||||||||||||||||||||
 |
||||||||||||||||||||||
La mayoría de los hidrocarburos tienen isómeros, que se presentan en los siguientes casos:
En los alcanos, por ejemplo, hay tres posibles pentanos, cinco hexanos, nueve heptanos... y hasta 75 decanos diferentes. |
||||||||||||||||||||||
| Alcoholes | ||||||||||||||||||||||
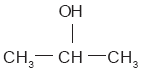
Las moléculas de hidrocarburos pueden enlazarse con átomos distintos del carbono y el hidrógeno por medio de reacciones químicas; esto hace que presenten propiedades diferentes. Por ejemplo, la oxidación de los hidrocarburos para sustituir un hidrógeno por un grupo OH (grupo hidroxilo) da lugar a los alcoholes. Para nombrar a los alcoholes se emplea el nombre del hidrocarburo, seguido de la terminación –ol. Algunos alcoholes tienen nombres comerciales. El más simple es el alcohol metílico o metanol (CH3—OH), pues tiene la cadena hidrocarbonada más corta. El metanol se utiliza en la fabricación del combustible para los aviones y en los anticongelantes para automóviles. No se debe confundir con el alcohol etílico o etanol (CH3—CH2—OH), que se encuentra en las bebidas alcohólicas. El metanol es muy venenoso y produce ceguera. El metanol y el etanol son alcoholes primarios porque el grupo OH está unido a un átomo de carbono del extremo de la cadena. El alcohol que sigue en tamaño al etanol es el propanol (CH3—CH2—CH2—OH), el cual tiene un isómero: el isopropanol o alcohol iso-propílico. |
||||||||||||||||||||||
 |
||||||||||||||||||||||
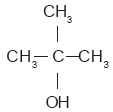
Este último compuesto se utiliza como desinfectante y con fines medicinales. A diferencia de los otros, se trata de un alcohol secundario porque el grupo OH se une a un átomo de carbono situado entre dos átomos del mismo elemento. En los alcoholes terciarios, el grupo OH se enlaza a un átomo de carbono cuyos tres enlaces restantes se unen con átomos de carbono. Ejemplo de alcohol terciario es el ter-butanol: |
||||||||||||||||||||||
 |
||||||||||||||||||||||
| Otros compuestos orgánicos | ||||||||||||||||||||||
| Aldehídos y cetonas | ||||||||||||||||||||||
Los alcoholes primarios pueden reaccionar con algunas sustancias que actúan como agentes oxidantes. Estas sustancias convierten el enlace sencillo que une los átomos de carbono y oxígeno en un enlace doble. Para ello deben quitar al carbono un átomo de hidrógeno y otro al oxígeno, ya que este último elemento tiene una valencia igual que dos. De esta forma se obtiene un aldehído. La terminación que se utiliza en los nombres de los aldehídos es –al. Por ejemplo, el etanol se oxida para producir etanal, cuyo nombre comercial es acetaldehído. La reacción se escribe como sigue: |
||||||||||||||||||||||
 |
||||||||||||||||||||||
La fórmula general de los aldehídos es: |
||||||||||||||||||||||
donde la R representa cualquier hidrocarburo. ¿Los alcoholes secundarios reaccionan también con los reactivos oxidantes? Sí, pero no se produce un aldehído, sino una cetona. La terminación utilizada en los nombres de las cetonas es –ona. Para formar estos compuestos es necesaria también la eliminación de dos átomos de hidrógeno, como se observa a continuación: |
||||||||||||||||||||||
 |
||||||||||||||||||||||
Esta cetona, conocida comúnmente como acetona, tiene un gran uso comercial, pues se utiliza como quitaesmalte. En seguida se muestra la fórmula general de las cetonas: |
||||||||||||||||||||||
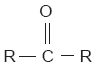 |
||||||||||||||||||||||
| Ácidos carboxílicos | ||||||||||||||||||||||
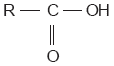
Los aldehídos pueden reaccionar con agentes oxidantes para producir compuestos conocidos como ácidos carboxílicos, cuya fórmula general es la siguiente: |
||||||||||||||||||||||
 |
||||||||||||||||||||||
Para que el aldehído produzca un ácido carboxílico, se debe sustituir un átomo de hidrógeno por un grupo hidroxilo (OH). En el caso del etanal, la reacción de oxidación se representaría así: |
||||||||||||||||||||||
 |
||||||||||||||||||||||
Para nombrar los ácidos carboxílicos se utiliza la terminación –oico. La sustancia formada en la reacción anterior es el ácido etanoico (CH3—COOH) o ácido acético, presente en el vinagre. |
||||||||||||||||||||||
| Ésteres | ||||||||||||||||||||||
¿Qué sucede si se hace reaccionar un ácido carboxílico con un alcohol? Se producen compuestos conocidos como ésteres. Las reacciones correspondientes se escriben, de forma general, como sigue: |
||||||||||||||||||||||
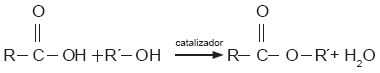 |
||||||||||||||||||||||
Donde R y R’ representan cualquier hidrocarburo. Para que la reacción se lleve a cabo, es necesario un catalizador, es decir, una sustancia que acelera la velocidad de una reacción, pero que no participa directamente en ella y por lo tanto no se consume. En el proceso se eliminan dos átomos de hidrógeno y uno de oxígeno, los cuales forman la molécula de agua (H2O). La fórmula general de los ésteres es: |
||||||||||||||||||||||
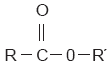 |
||||||||||||||||||||||
Para nombrar un éster se reemplaza la terminación –ico por –ato en la denominación del ácido de que se deriva. Al grupo R’, proveniente del alcohol, se le asigna la terminación –ilo. Por ejemplo, el butanoato de etilo se sintetiza a partir del ácido butanoico y del etanol; su fórmula semidesarrollada es: |
||||||||||||||||||||||
Los ésteres se encuentran a menudo en la naturaleza; producen los olores y sabores de muchas frutas. |
||||||||||||||||||||||
| Carbohidratos | ||||||||||||||||||||||
Los carbohidratos, glúcidos o azúcares son compuestos formados por carbono (C), hidrógeno (H) y oxígeno (O). Uno de los carbohidratos más comunes es la glucosa, cuya fórmula es C6H12O6. La glucosa tiene un isómero llamado fructuosa (C6H12O6); cuando estos dos compuestos se unen, forman la sacarosa o azúcar común (C12H22O11). Las moléculas de carbohidratos se unen fácilmente unas con otras para formar largas cadenas o polímeros. Los polímeros formados de esta manera reciben el nombre de polisacáridos. La celulosa que forma el tronco de los árboles y el almidón, presente en granos y tubérculos, son ejemplos de polisacáridos. Como la mayoría de los carbohidratos o glúcidos están constituidos por unidades con una estructura química similar, la combustión de todas estas sustancias produce la misma cantidad de energía, cerca de 4000 calorías (4 kilocalorías o 4 kcal) por cada gramo de compuesto que se quema. Una caloría es la cantidad de calor que se requiere para elevar 1°C 1 gramo de agua. |
||||||||||||||||||||||
| Grasas | ||||||||||||||||||||||
Las grasas son compuestos químicos que también están formados por carbono (C), hidrógeno (H) y oxígeno (O), pero contienen menos oxígeno que los carbohidratos; forman parte de los lípidos, un grupo de compuestos presentes en los tejidos de los seres vivos. Las grasas se encuentran en los aceites naturales, la crema, la mantequilla y otros productos de origen animal. El cuerpo humano almacena la energía sobrante en forma de grasas, las cuales se acumulan alrededor de algunos órganos y debajo de la piel. Las grasas son excelentes combustibles, pues liberan cerca de 9 kcal de energía por cada gramo que se quema; por esa razón, son utilizadas por el cuerpo para almacenar energía. |
||||||||||||||||||||||
| Proteínas | ||||||||||||||||||||||
La tercera fuente de energía presente en los alimentos son las proteínas. Estos compuestos forman la estructura de todos los tejidos. La piel, el pelo, los huesos y los músculos de un ser humano están formados por proteínas. Las enzimas (o catalizadores naturales presentes en los organismos) encargadas de regular el metabolismo de los seres vivos también son proteínas. Las proteínas son polímeros naturales, formados por la unión de monómeros conocidos como aminoácidos. El carbono (C), el hidrógeno (H), el oxígeno (O) y el nitrógeno (N) son sus elementos principales. Existen 20 tipos de aminoácidos, y en una proteína se unen cientos de ellos. La mayor parte de las proteínas ingeridas en los alimentos son utilizadas por el cuerpo para construir los tejidos y las enzimas que requiere. Sólo en situaciones extremas, el cuerpo las oxida para obtener energía (por ejemplo, en casos de desnutrición extrema); cuando lo hace, se obtienen cerca de 4 kcal de energía por cada gramo de proteína quemada. Los tres componentes principales de los alimentos cumplen una función esencial en el metabolismo corporal:
En general, se recomienda que el 60% de la energía obtenida de los alimentos provenga de los carbohidratos. Para consumir una dieta balanceada o equilibrada, no debe ingerirse en exceso ninguno de estos componentes; pero, sobre todo, hay que tener cuidado con el consumo de grasas pues son difíciles de eliminar. |
||||||||||||||||||||||
Describa brevemente y anote dos ejemplos de cada tipo de hidrocarburo descrito en la lectura. |
||||||||||||||||||||||
Debe incluir información sobre: Alcanos, Hidrocarburos cíclicos, Aldehídos y cetonas. Alquenos y alquinos, Hidrocarburos aromáticos, Ácidos carboxílicos. Hidrocarburos ramificados, Alcoholes, Ésteres. Carbohidratos, Grasas, Proteínas. |
||||||||||||||||||||||
| Conteste las siguientes preguntas. | ||||||||||||||||||||||
| ¿Qué es un isómero? | ||||||||||||||||||||||
| Escriba por lo menos tres isómeros del hexano. | ||||||||||||||||||||||
|
|