| Asignación de números de oxidación y electrólisis | ||||||||||||||||||||
| Reglas para asignar número de oxidación | ||||||||||||||||||||
Como se tienen 3 oxígenos en la fórmula, el número de cargas positivas es: 3 (–2) = –6 Al haber sólo un hidrógeno con carga positiva neutraliza una carga negativa de las seis del oxígeno. |
||||||||||||||||||||
 |
||||||||||||||||||||
Por lo tanto, el número de
oxidación del nitrógeno debe ser +5 para que la molécula
sea neutra. Al ejercicio anterior se le conoce como balanceo de
carga. |
||||||||||||||||||||
| Oxidación y reducción como cambios del número de oxidación | ||||||||||||||||||||
Una vez definidos los números de oxidación, solo falta determinar si cambian durante una reacción química. Para hacerlo, se deben conocer los números de oxidación de los elementos antes y después de la reacción, y compararlos para saber que pasó con ellos. Si algunos números de oxidación cambian, ha ocurrido una reacción de oxidación - reducción. Cuando todos los números de oxidación permanecen iguales, la reacción fue de otro tipo. Esto se aclarará con un ejemplo. La molécula del agua se forma mediante la combinación del oxígeno (O2) y el hidrógeno (H2), ambos en estado gaseoso. La ecuación balanceada es la siguiente: |
||||||||||||||||||||
Para saber si una reacción
es de oxidación - reducción, se escriben los números
de oxidación de todos los elementos que intervienen en ella.
El hidrógeno y el oxígeno son elementos, y su número
de oxidación es cero. Cuando forman parte del agua, el hidrógeno
tiene como número de oxidación +1 y el oxígeno,
-2. En la ecuación química se acostumbra colocar los
números de oxidación en la parte superior derecha
de cada elemento. La ecuación anterior queda de la siguiente
manera: |
||||||||||||||||||||
Durante la reacción el número de oxidación del hidrógeno aumentó de cero a +1 y el del oxígeno disminuyó de cero a -2; ello implica que el hidrógeno se oxidó y el oxígeno se redujo. Nunca se presenta una oxidación sin que ocurra una reducción. El mundo es eléctricamente neutro; por eso el número de electrones perdidos por el elemento que se oxida debe ser igual que el de electrones ganados por el elemento que se reduce. Ésta es la base del balanceo de las reacciones de oxidación-reducción. |
||||||||||||||||||||
| Electrólisis | ||||||||||||||||||||
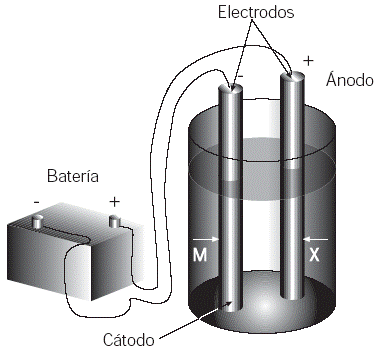
La electricidad se ha convertido en un elemento indispensable en la vida moderna, que utilizamos todos los días y en todo momento. No siempre se aprecia su gran valor, pues a través de ella se obtienen muchos más productos y servicios que el simple foco que alumbra. Una rama de la Química, la electroquímica, estudia los cambios químicos que se producen por el paso de corriente eléctrica a través de disoluciones electrolíticas. En esta disciplina se estudia también el proceso inverso, a saber, la producción de energía eléctrica por medio de reacciones químicas. A lo largo de los años, el estudio de la electroquímica ha dado lugar a muchos conocimientos acerca de las reacciones de óxido-reducción y, como consecuencia de ello, al desarrollo de una próspera industria que produce gran cantidad de materiales de uso cotidiano. Se conoce como electrólisis a los procesos o reacciones redox (reducción-oxidación) que no se logran de manera espontánea y que sólo se producen por una fuente externa de energía eléctrica. Estos procesos tienen lugar en las celdas electrolíticas, las cuales consisten de un electrólito fundido (o disolución acuosa de un electrólito), un par de electrodos y una fuente de corriente eléctrica. Los electrodos suelen ser superficies metálicas que están sumergidas en el electrólito, en las que se producen las reacciones de oxidación y reducción, y pueden o no intervenir en el proceso. Los que no lo hacen se denominan electrodos inertes. La fuente de corriente eléctrica es generalmente una batería o pila que actúa como una bomba de electrones, sacándolos de uno de los electrodos y atrayéndolos por el otro. Como consecuencia del movimiento de electrones, el electrodo que los recibe adquiere una carga negativa y atrae a los iones positivos o cationes. Este electrodo recibe el nombre de cátodo y en él se verifican las reducciones, pues ahí algunas especies generan electrones. De manera inversa, el electrodo que pierde electrones obtiene una carga positiva y capta los iones negativos o aniones. A este electrodo se le denomina ánodo y en él se producen las oxidaciones y las especies pierden electrones. Las reacciones de óxido-reducción implican siempre cambios en el número de oxidación de algunos elementos en los reactivos. En los ejemplos más simples se presenta una pérdida real de electrones en una especie, con la correspondiente ganancia de otro, pero cuando la reacción se lleva a cabo en una celda electrolítica, oxidación y reducción se desarrollan simultáneamente aunque en sitios diferentes. El intercambio de electrones se realiza a través de los electrodos. Los aniones en disolución siempre se oxidan en el ánodo y los cationes se reducen siempre en el cátodo. Es importante destacar que en la electrólisis se llevan a cabo los dos tipos de conducción eléctrica: iónica y metálica, y que en una celda electrolítica se convierte energía eléctrica en energía química, es decir, en energía almacenada en los enlaces entre los átomos. Los productos de la electrólisis son distintos si el electrólito se encuentra puro (fundido) o está en disolución acuosa. Es el caso de una disolución concentrada de cloruro de sodio (NaCl). Durante la electrólisis se llevan a cabo las siguientes reacciones: |
||||||||||||||||||||
 |
||||||||||||||||||||
En cambio, cuando la electrólisis
se realiza sobre el electrólito fundido, se obtienen sodio
metálico (Na) y cloro gaseoso (Cl2). Así,
se efectúan las siguientes reacciones: |
||||||||||||||||||||
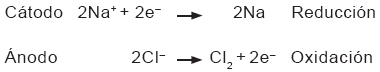 |
||||||||||||||||||||
| Pilas | ||||||||||||||||||||
Se calcula que en el mundo occidental cada persona consume, en promedio, cinco pilas al año. Cada hombre, mujer y niño encuentra en este sencillo y práctico dispositivo una fuente invaluable de energía para hacer funcionar un sinfín de aparatos eléctricos, que van desde radios y relojes, hasta juguetes. Veamos ahora por qué son tan útiles y cómo funcionan. El mecanismo básico de funcionamiento de una pila actual es esencialmente el mismo que el de las primeras pilas: implica el uso de sustancias químicas colocadas de tal manera que los electrones se liberan desde un extremo de la pila hacia el otro, a través de un circuito externo. Todo el proceso se lleva a cabo en una celda electrolítica. De forma contraria a lo que ocurre en la electrólisis, la parte de la pila de donde se liberan los electrones al circuito es, por convención, el ánodo o electrodo negativo, que generalmente es un metal en donde ocurre la reacción de oxidación; y el otro extremo de la pila es el cátodo o electrodo positivo, que consiste de sales u óxidos metálicos capaces de aceptar electrones y en donde ocurre la reacción de reducción. Para que el mecanismo funcione, cátodo y ánodo deben estar colocados en un medio electrólito (que puede ser líquido o sólido) y deben también estar unidos a través de un material conductor. Cuando inician la reacción, los electrones salen de la celda y viajan por el conductor que une a los electrodos. Al llegar al electrólito, la corriente es transportada por los iones en disolución hasta que se cierra el circuito. Esta corriente continua de electrones es lo que hace que funcionen las pilas. |
||||||||||||||||||||
 |
||||||||||||||||||||
Fig. 1 Diagrama esquemático de una celda electrolítica. |
||||||||||||||||||||
| Complete la siguiente tabla: | ||||||||||||||||||||
|
||||||||||||||||||||
|
Responda las siguientes preguntas: |
||||||||||||||||||||
| ¿Qué estudia la electroquímica? | ||||||||||||||||||||
| ¿Qué es la electrólisis? | ||||||||||||||||||||
| ¿Qué es un electrodo? | ||||||||||||||||||||
| ¿Qué tipos de pilas existen? | ||||||||||||||||||||