| Clasificación de las reacciones químicas | ||||||||||||||||||||||
Las reacciones químicas se clasifican por la energía que requieren o liberan, o bien por el proceso a que se someten los reactivos. Si una reacción química libera energía, se llama reacción exotérmica. El ejemplo más común es la combustión, en la cual la energía se manifiesta en forma de calor y luz. Si, por el contrario, la reacción química requiere energía del medio para efectuarse, recibe el nombre de reacción endotérmica. La fotosíntesis es un proceso de esta clase, porque requiere de la luz solar para realizarse. Dos tipos de reacciones consideradas muy importantes son las de síntesis y las de descomposición.
|
||||||||||||||||||||||
 |
||||||||||||||||||||||
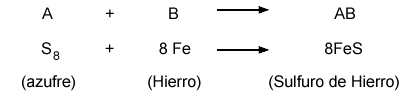
Las reacciones de este tipo tienen gran utilidad industrial; gracias a ellas, cada día se cuenta con nuevos productos, como medicamentos, plástico, materiales cerámicos, etc.
Muchas reacciones de descomposición requieren energía eléctrica para llevarse a cabo; por ejemplo, mediante la corriente eléctrica se pueden separar el oxígeno y el hidrógeno que forman el agua. El proceso que consiste en separar sustancias químicamente por medio de la electricidad se conoce como electrólisis. |
||||||||||||||||||||||
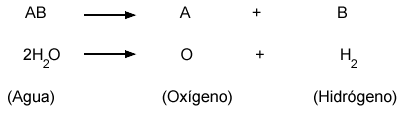 |
||||||||||||||||||||||
La información contenida en una reacción química |
||||||||||||||||||||||
Una ecuación química es una forma sencilla de describrir una reacción química: es como una oración gramatical, donde se usan fórmulas y símbolos en lugar de palabras. Por medio de una ecuación química se proporciona mucha información de manera concisa y breve. El magnesio metálico y el oxígeno del aire dan lugar a una reacción de combustión, que produce óxido de magnesio. La ecuación que describe esta reacción es la siguiente: |
||||||||||||||||||||||
En una ecuación química, el signo “+” se lee como “reacciona con” y la flecha, como “produce”. Los compuestos o elementos que aparecen del lado izquierdo de la flecha se denominan reactivos, y los de lado derecho, productos. En el ejemplo, los reactivos son el magnesio y el oxígeno; el producto, el óxido de magnesio. El estado físico de las sustancias que intervienen en una reacción química también se indica en la ecuación; para ello se anotan subíndices entre paréntesis después de cada fórmula. Se usa el subíndice (s) cuando la sustancia aparece en estado sólido, (l) si es líquida y (g) cuando se presenta en forma de gas. Si alguno de los reactivos o productos está en disolución acuosa, se escribe (ac). Las condiciones necesarias para efectuar una reacción pueden señalarse arriba o abajo de la flecha; éste seria el caso de alguna temperatura o presión determinadas. Una delta mayúscula (Ð), colocada sobre la flecha, indica que debe suministrarse calor para que se produzca la reacción. Ejemplo: |
||||||||||||||||||||||
En el cuadro de abajo, están
los símbolos de uso común en las reacciones químicas. |
||||||||||||||||||||||
|
||||||||||||||||||||||
| Balanceo de reacciones de síntesis | ||||||||||||||||||||||
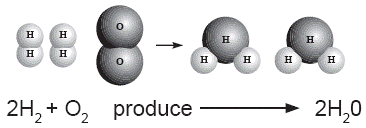
Como una ecuación química es la descripción de un proceso químico, para escribir una ecuación completa es necesario saber qué sucede en la reacción, o sea, conocer los reactivos y los productos. En este sentido, una ecuación química tiene un significado cualitativo. Sin embargo, las ecuaciones químicas poseen también una expresión cuantitativa, que debe ser consistente con la ley de conservación de la materia. Esto significa que una ecuación debe contener el mismo número de átomos de cada tipo en ambos lados. Cuando este requisito se cumple, la ecuación está balanceada. Para balancear una ecuación química se anteponen a cada fórmula números enteros, llamados coeficientes estequiométricos. Estos números indican la cantidad de átomos o moléculas que intervienen en la reacción y el número de moles de reactivos y productos. Considérese, por ejemplo, la reacción que da como resultado el agua: |
||||||||||||||||||||||
Esta ecuación indica que
dos moléculas de hidrógeno, o dos moles de moléculas
de hidrógeno, reaccionan con una molécula de oxígeno,
o un mol de moléculas de oxígeno, para generar dos
moléculas de agua, o dos moles de moléculas de agua. |
||||||||||||||||||||||
 |
||||||||||||||||||||||
Existen varios métodos para balancear ecuaciones; el más sencillo es conocido como balanceo por tanteo. Algunas ecuaciones se balancean fácilmente por tanteo, pero es necesario poner atención en el procedimiento y cuidar que se cumpla la ley de conservación de la materia. El método de balanceo por tanteo consiste en ajustar el número de átomos de cada elemento para que coincida en ambos lados de la ecuación. Nunca debe cambiarse la fórmula de un compuesto para obtener una ecuación balanceada, es decir, se deben respetar siempre los subíndices. No existe una sola manera de balancear las reacciones por tanteo; cada reacción debe tratarse de manera individual. Sólo la práctica permitirá hacer esto con rapidez y facilidad. Las reacciones de síntesis son aquellas en que dos reactivos se combinan para dar un producto. La forma general de la ecuación correspondiente es ésta: |
||||||||||||||||||||||
| Donde A y B son elementos o compuestos y AB es siempre un compuesto. Para balancear una reacción de síntesis pueden seguirse los siguientes pasos:
A continuación se presentan algunos ejemplos de balanceo por tanteo. En la reacción de síntesis del cloruro de hidrógeno (o ácido clorhídrico), se presentan las siguientes especies: |
||||||||||||||||||||||
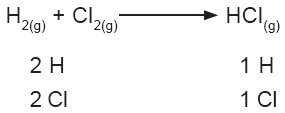 |
||||||||||||||||||||||
Si se cuentan los átomos de la ecuación, puede observarse que del lado izquierdo hay dos de hidrógeno y dos de cloro, mientras que del derecho sólo hay un átomo de cada elemento. Se coloca un número 2 delante de la fórmula del cloruro de hidrógeno, y la ecuación queda balanceada. |
||||||||||||||||||||||
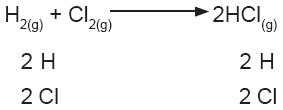 |
||||||||||||||||||||||