| Enlace iónico, covalente y metálico | |
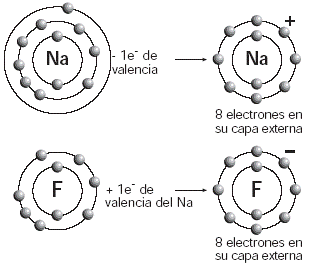
En los primeros años del siglo XIX, el sueco J. J. Berzelius descubrió que algunas sales disueltas en agua conducen la electricidad; sobre la base de este hecho, postuló la existencia de polos eléctricos, positivo y negativo, en este tipo de compuestos. Cien años después, con una enorme cantidad de evidencias experimentales acumuladas, el físico alemán Walter Kossel (1888-1956) propuso el denominado modelo de enlace iónico. En este modelo, un átomo del compuesto cede uno o varios electrones (electrones de valencia) a otro para quedar con ocho electrones en su capa más externa. Por tanto, el átomo que cede electrones adquiere una carga eléctrica positiva y se convierte en un ión positivo o catión (Fig. 1). El átomo que gana el electrón o los electrones cedidos completa el octeto en su capa de valencia y queda también cargado eléctricamente, aunque su carga es negativa; por consiguiente, forma un ión negativo o anión. |
|
 |
|
Fig. 1 Los metales ceden electrones de valencia a los no metales en la formación de sales. |
|
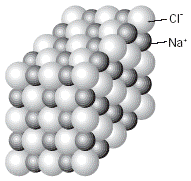
Los iones resultantes, con cargas eléctricas opuestas, se atraen uno al otro. Esta fuerza de cohesión los mantiene juntos, formando un compuesto de tipo iónico. Los compuestos con enlaces iónicos constituyen cristales, no moléculas simples, pues la atracción de los iones produce un arreglo llamado red cristalina (Fig. 2). El enlace iónico se presenta cuando un metal de las familias 1 (alcalino) o 2 (alcalino-térreo) de la Tabla Periódica reacciona con un no metal para integrar un compuesto. Por ejemplo, el cloruro de sodio es un compuesto iónico formado por el metal sodio, de la familia 1, y el no metal cloro. |
|
 |
|
Fig. 2 Estructura cristalina del cloruro de sodio. |
|
Cuando el sodio cede su electrón
de valencia, se produce el ión sodio, con carga positiva;
el cloro acepta este electrón y se forma el ion cloro, con
carga negativa. Los dos iones cuentan con 8 electrones en su capa
más externa y se atraen entre sí, pues poseen cargas
opuestas. El compuesto resultante es eléctricamente neutro,
es decir, carece de carga. |
|
Los compuestos iónicos son
sólidos cristalinos, solubles en agua y conducen la electricidad
fundidos o en disolución. Estas características obedecen
al tipo de enlace que los mantiene unidos. |
|
| Enlace covalente | |
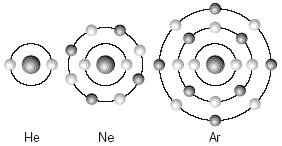
Mientras Berzelius trataba de explicar la conducción de la corriente eléctrica en algunas disoluciones acuosas, otros científicos descubrieron que no todas las sustancias disueltas en agua conducen la electricidad. Con el tiempo, este hecho dio lugar a otro modelo de enlace que explica, de forma satisfactoria, el comportamiento de estas sustancias. Fue precisamente Lewis quien, en 1916, propuso el modelo de enlace covalente. Con este tipo de enlace, los átomos adquieren la estructura de los gases nobles, es decir, se quedan con 8 electrones o capa llena en cada órbita, lo cual los hace muy estables. Los gases nobles son elementos que siempre cumplen con esta regla llamada del octeto (Fig. 3). Se dice que una molécula tiene un enlace covalente cuando todos los átomos que la constituyen comparten sus electrones de manera que cada uno presenta ocho electrones en su capa de valencia. |
|
 |
|
Fig. 3 Arreglo electrónico de los gases nobles: en todos ellos se encuentra saturada la capa de valencia. |
|
Para explicar, por ejemplo, la formación
de la molécula de flúor (F2) basta saber
que un átomo de este elemento cuenta con siete electrones
en su capa de valencia y si dos átomos comparten un electrón,
poseerán ocho electrones en su última capa. Por tanto,
cumplirán la regla del octeto. |
|
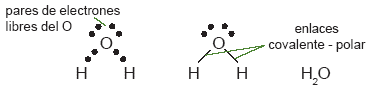
Los enlaces covalentes se presentan principalmente entre no metales y se indican con una raya entre los símbolos de los átomos que los forman; ésta representa el par de electrones compartidos. Por ejemplo, F2 se puede representar así F–F. Existen dos tipos de enlaces covalentes: el covalente puro, que se presenta entre átomos iguales, como el F2 y el covalente polar, que ocurre entre átomos diferentes. Por ejemplo, el agua es una molécula con dos enlaces covalentes polares, donde el átomo de oxígeno comparte un par de electrones con cada átomo de hidrógeno. |
|
 |
|
Los compuestos formados por enlaces covalentes son más abundantes que los iónicos y pueden ser sólidos, líquidos o gaseosos. Casi todos son insolubles en agua y son malos conductores de la energía eléctrica. Basta señalar que la mayoría de constituyentes de los seres vivos y de los nutrimentos presentes que están en la dieta de cualquier persona son compuestos con enlaces covalentes. Con átomos de carbono, hidrógeno y oxígeno se forman millones de compuestos, en los cuales cada átomo de carbono forma siempre cuatro enlaces covalentes. Dada la enorme cantidad de compuestos formados con carbono, una parte de la Química está dedicada a su estudio: la Química Orgánica. |
|
| Enlaces dobles y triples | |
El enlace covalente en que se comparte sólo un par de electrones se llama enlace simple. En ocasiones, los átomos pueden compartir más de una pareja de electrones para completar el octeto. Éste es el caso del átomo de oxígeno, que posee seis electrones de valencia y, para completar su octeto, debe compartir dos pares de electrones con otro átomo del mismo elemento. Una molécula de oxígeno muestra dos enlaces covalentes; por ello se dice que presenta un enlace doble o un doble enlace covalente. Éste se representa así por medio de las estructuras de Lewis: |
|
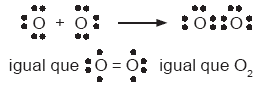 |
|
El átomo de nitrógeno
cuenta con cinco electrones en su capa de valencia y, por lo mismo,
necesita tres electrones para completar el octeto. Para formar la
molécula de nitrógeno (N2), los átomos
comparten tres pares de electrones; como resultado, se forma un
enlace triple, que se representa así: |
|
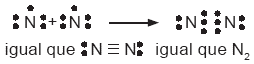 |
|
Muchos compuestos se forman por la unión de átomos a través de enlaces dobles y triples. Tal es el caso del dióxido de carbono, que en su forma sólida se conoce como hielo seco, y del acetileno, gas empleado para soldar, ya que su flama es muy caliente y adecuada para fundir metales. 0 = C = 0 |
|
| Enlace metálico | |
El enlace metálico ocurre en los metales puros y en las aleaciones. Como en el enlace covalente, los átomos comparten pares de electrones; pero, en el metálico, muchos átomos comparten muchos electrones. Los electrones de valencia de un metal puro, como la plata o el cobre, forman un chorro de electrones que fluyen libremente a través de la pieza de metal. Como los electrones no pertenecen a ningún átomo en particular, los átomos existen como iones positivos, que se neutralizan con las cargas negativas de todos los electrones. Los metales forman una red cristalina, como se aprecia en la Fig. 4. Este modelo de enlace explica muchas propiedades de los metales. En seguida se describen algunas de ellas:
|
|
 |
|
Fig. 4 En el enlace metálico, los metales se comportan como iones, sus cargas se neutralizan con los electrones móviles. |
|
|
Responda las siguientes preguntas: |
|
| Describa
brevemente el enlace iónico. Mencione un ejemplo de sustancia
preferentemente iónica. |
|
| Describa brevemente el enlace covalente. | |
El
azúcar, la sal y el acero son tres sustancias que tienen
en común una cosa. ¿Qué tipo de enlace se da
preferentemente en cada una? Explique su respuesta. |
|