| Productos derivados del oxígeno y la combustión | |
| Los óxidos | |
El oxígeno tiene una gran
capacidad para combinarse con otros elementos y compuestos y formar
nuevas sustancias, denominadas óxidos. |
|
| Óxidos básicos y óxidos ácidos | |
| Los óxidos se clasifican en básicos y ácidos. Cuando el oxígeno reacciona con elementos metálicos, como el sodio (Na) y el magnesio (Mg) da lugar a óxidos básicos. Por ejemplo: Óxido de sodio 2Na(s) + O2(g) Óxido de magnesio 2Mg(s) + O2(g) Estos óxidos se denominan básicos porque generan sustancias básicas cuando son disueltos en agua: Hidróxido de sodio Na2O(s)+ H2O(l)
Hidróxido de magnesio 2MgO(s)+ 2H2O(l)
Cuando el oxígeno reacciona con elementos no metálicos, como el carbono (C) forma óxidos ácidos: C(s) + O2(g) Estos óxidos generan sustancias ácidas al disolverse en agua. CO2(g) + H20(l)
|
|
| Dióxido de carbono y calentamiento global del planeta | |
El dióxido de carbono CO2
producido en una combustión se integra a la atmósfera
terrestre. Junto con el vapor de agua y la energía del Sol,
este gas ayuda a mantener la temperatura promedio del planeta, que
es 15 °C. Esto se debe al fenómeno conocido como efecto
invernadero. |
|
 |
|
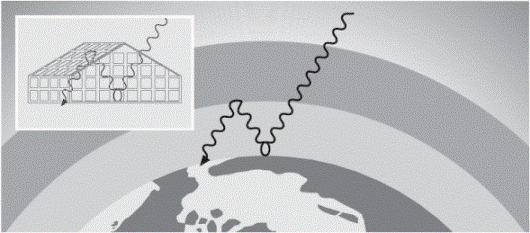
Fig. 1 Efecto invernadero en la Tierra y en un invernadero. La energía que debería escapar al espacio se queda en la atmósfera y provoca un incremento de temperatura. |
|
| El efecto invernadero | |
Una parte de la radiación solar que llega a la superficie terrestre se refleja al espacio en forma de rayos infrarrojos. Sin embargo, el dióxido de carbono CO2 absorbe este tipo de radiación, lo cual provoca que sus moléculas gaseosas vibren más rápido y, por consiguiente, que la temperatura de la atmósfera aumente. De esta forma, la energía queda atrapada en la Tierra (Fig. 1). Este fenómeno es conocido como efecto invernadero porque se produce también en los invernaderos que las personas construyen con techos y paredes de vidrio o plástico. Estos materiales permiten la entrada de la radiación solar que, una vez dentro, se absorbe y conserva, lo que aumenta la temperatura. Los invernaderos posibilitan el cultivo de plantas tropicales aun en lugares fríos. La temperatura de la Tierra se mantiene constante gracias al efecto invernadero; esto ocurrirá mientras la concentración de dióxido de carbono (CO2) no aumente o disminuya demasiado. La cantidad de este gas es regulada de manera natural, siempre que no haya muchas industrias o muchos automóviles. |
|
| El CO2 y el calentamiento global del planeta | |
El dióxido de carbono (CO2) generado en el proceso de respiración, en los incendios forestales y en los procesos de descomposición de la materia orgánica se consume durante la fotosíntesis, proceso que realizan los organismos vegetales para producir sus alimentos. De esta forma, la concentración de dióxido de carbono (CO2) puede permanecer prácticamente constante. Sin embargo, en la actualidad nuestro planeta se ha visto transformado por la creciente explosión demográfica y las consecuencias que ésta tiene. El consumo excesivo de los combustibles empleados en los medios de transporte, en la generación de electricidad y en distintas industrias, ha producido mucho dióxido de carbono. Como la combustión de la madera y los combustibles fósiles generan dióxido de carbono (CO2), la cantidad de gases producidos en los diversos procesos de combustión, necesarios para mantener la mayoría de las actividades de la sociedad actual, es muy superior a la generada por fuentes naturales. Este fenómeno ha dado lugar a un aumento considerable en la cantidad de dióxido de carbono presente en la atmósfera que ya no puede ser reciclado por los vegetales mediante la fotosíntesis. Si a esto se le suma el hecho de que cada vez hay menos zonas con organismos vegetales en la superficie del planeta, es fácil darse cuenta de que los mecanismos de regulación natural ya no son tan eficientes. El aumento en la concentración de dióxido de carbono en la atmósfera parece haber producido un incremento en la temperatura promedio del planeta. |
|
| Lluvia ácida | |
La lluvia natural es ligeramente ácida. Esto se debe a que, en su viaje de las nubes hasta la superficie terrestre, el agua de lluvia disuelve parte del CO2 de la atmósfera y forma ácido carbónico (H2CO3), que es un ácido débil. CO2(g) + H20(l)
Si la atmósfera está contaminada por óxidos de azufre y de nitrógeno, se producen los ácidos sulfúrico (H2SO4), nitroso (HNO2) y nítrico (HNO3). SO3(g) + H20(l)
2NO2(g) + H20(l)
La lluvia contaminada con estos ácidos se conoce como lluvia ácida y llega a ser tan ácida como el jugo de limón. La lluvia ácida provoca oxidación y corrosión de metales, que la fotosíntesis se realice lentamente, que mueran las plantas y, por supuesto, los peces de lagos y ríos. En ocasiones, los lagos tienen suelos con gran cantidad de carbonatos; estos compuestos reaccionan con la lluvia ácida y la neutralizan, es decir, anulan la acidez del agua. De esta manera, algunos lagos se protegen naturalmente de los efectos de la lluvia ácida, que no por ello deja de ser un problema grave de contaminación. |
|
Describa cómo se forman los siguientes óxidos y anote
un ejemplo. |
|
| Óxidos ácidos | |
| Óxidos básicos | |
Anote
dos o tres productos que usted conozca que se oxidan. ¿Qué
tipos de óxidos son? |
|