| El calor y los cambios de estado. | |||||||||||||||||||||
| Para establecer la escala de temperatura, Celsius utilizó el congelamiento y la ebullición del agua como puntos de referencia. ¿Qué significan esos conceptos?, ¿sólo se aplican al agua? Toda la materia tiene tres estados de agregación: sólido, líquido y gaseoso, también llamados fases de la materia. Bajo ciertas condiciones, es posible que una sustancia cualquiera pase de un estado a otro. El caso más familiar para nosotros es el del agua, la cual hemos visto pasar de líquido a sólido (hielo) o a gas (vapor de agua). Existen, desde luego, otros cambios que ocurren en las sustancias (Tabla 1). |
|||||||||||||||||||||
|
|||||||||||||||||||||
Tabla 1 Cambios de estado de la materia. |
|||||||||||||||||||||
Joseph Black también estudió los cambios de estado y observó que en dicho proceso la temperatura de las sustancias no aumentaba ni disminuía, a pesar de seguir suministrando o transfiriendo calor, según el caso. Por ejemplo, cuando el agua llega a 100 °C (a nivel del mar) comienza a hervir, pero conforme se evapora, la temperatura se mantiene en 100 °C. Puede aumentar cuando ya está en forma de vapor, pero ¿por qué no aumenta o disminuye la temperatura durante el cambio de estado? Black encontró experimentalmente que cada sustancia requería de una cierta cantidad de calor para pasar de un estado, o fase, a otro, y que si bien no había aumento o disminución de la temperatura, algo ocurría en la materia que producía el cambio. A la cantidad de calor necesaria para el cambio de fase se le denominó calor latente. En el caso de pasar de líquido a gas se le llama calor latente de ebullición (Lebullición) y en el cambio de sólido a líquido, calor latente de fusión (Lfusión) (Tabla 2). |
|||||||||||||||||||||
|
|||||||||||||||||||||
Tabla 2 Valores de calor latente de fusión y de ebullición para algunas sustancias. |
|||||||||||||||||||||
La cantidad de calor requerida para
el cambio de estado se obtiene al multiplicar la masa de la sustancia
por el valor constante del calor latente: |
|||||||||||||||||||||
Q = m L |
|||||||||||||||||||||
Esta expresión indica que el calor transferido en un cambio de estado no depende de la temperatura, pero sí de la cantidad de sustancia, representada por la masa. La constante L es característica de cada material y está determinada por sus propiedades moleculares. El hecho de que la temperatura no aumenta o disminuya en los cambios de estado, pero que para lograrlos se requiera de cierta cantidad de calor, nos lleva a preguntar qué ocurre en la materia con ese calor latente. En la descripción molecular y atómica de la materia, como hemos visto, los estados se representan por el movimiento de las moléculas y los átomos. En el caso de los sólidos, las moléculas y átomos vibran sin desplazarse de un lugar a otro debido a fuerzas que impiden que se separen. Cuando la temperatura llega a la requerida para el cambio de fase (por ejemplo, de sólido a líquido), las moléculas y los átomos se encuentran agitados, pero aún no logran superar las fuerzas que los mantienen en posiciones fijas. La cantidad de energía requerida para lograr que esas moléculas y átomos se liberen y puedan desplazarse es el calor latente, que aumenta la energía cinética, tanto de las moléculas como de los átomos, y permite que una sustancia pase de sólido a líquido o de líquido a gas y, a veces, de sólido a gas. En el caso de que el cambio de estado requiera de una disminución de la temperatura, el calor latente es la energía transferida por la sustancia. La representación molecular implica que los átomos y las moléculas pierden energía cinética. Si el cambio es de gas a líquido, por ejemplo, las moléculas de moverse libremente lo harán con mayores restricciones, y al pasar a sólido, vibrarán localmente. |
|||||||||||||||||||||
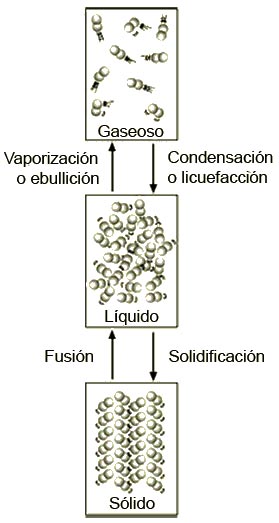 |
|||||||||||||||||||||
Fig. 1 Cuando las sustancias cambian de una fase a otra, la energía cinética de sus moléculas también cambia. |
|||||||||||||||||||||
| Imprima
o copie en su cuaderno de apuntes si lo considera necesario. Responda
las siguientes preguntas: |
|||||||||||||||||||||
| ¿Qué es un cambio de fase? | |||||||||||||||||||||
Explique
qué es el calor latente de fusión y de ebullición. |
|||||||||||||||||||||
¿Por
qué no aumenta la temperatura de una sustancia cuando cambia
de fase? |
|||||||||||||||||||||